المحلول الذي يتم إرجاع الأس الهُباني (أها) الخاص به تلقائيا إلى قيمة التوازن، بفضل وجود بعض الأملاح الذائبة، ومنظِّمات التوازن الحمضي- القِمْطي. فهو محلول مركز بدرجة معقولة يظل أسّه الهباني ثابتا إلى حد كبير على الرغم من إضافة حمض أو قِمْط أو على الرغم من ترخيفه (تخفيفه). والمحاليل المنظّمة هي عادة مزيج من حمض ضعيف وملحه (س.ها3س.ك.ك.ها، وس.ها3س.ك.ك.ق) أو مزيج من قمط ضعيف وملحه (مثل: ع.ها3، وع.ها4سن)، ولا بدّ من وجود المكوّنين معا. لا تتغيّر قيمة «الأها» للمحاليل المنظّمة أو قد يطرأ عليها تغيّر طفيف عندما تضاف إليها كمّية قليلة من حمض قوي حرّ، أو قِمْط قوي أو عند ترخيفها أو تركيزها. مثال: إضافة 0,2 ماد من حمض السَّنُوخ (حمض الهيدروكلوريك) إلى كال واحد من الماء يخفّض قيمة «الأها» من 7 إلى 5، ولكن عند إضافة الكمّية نفسها من الحمض إلى محلول متعادل، يحتوي على خليط من أملاح الهَوْبَص (أملاح الفوسفات) نجد أنّ «الأها» لا يتغيّر، ويُسمّى مثل هذا المحلول بالمحلول المنظِّم.
تستعمل المحاليل المنظّمة على نطاق واسع في مختلف مجالات الأبحاث الكيميائية، ولها أهمّية كبيرة في العمليات التي تجري في الأجسام الحيّة، فالمعدة تؤدّي وظيفتها عند مدى معيّن من «الأها» في حدود 1,5، والذي يتحقّق من خلال المحاليل المنظّمة، تقدّر قيمة «الأها» للدم 7,4 تقريبا، تبقى هذه القيمة ثابتة بفضل مخاليط منظِّمة من السَّوْخَم (الكربونات) والهَوْبَص (الفوسفات). ومثل ذلك الكثير من الغدد التي تعمل بكفاءة على مدى معيّن من الأسّ الهباني، ويختلّ عمل هذه الغدد في حال ما اختلّ هذا الأسّ. تعدّ قيمة «الأها» أساس العمل الصحيح «للأنزيمات» ومعادلة الضغط التناضحي (الأسموزي) في الجسم، وتحافظ على قيمها على الأغلب عن طريق المحاليل المنظِّمة التي يجب أن تحتوي على تركيز نسبي عالٍ من الحمض اللازم للتفاعل مع أي شوارد ك.ها- التي من الممكن إضافتها إليه، ويجب أن يحتوي على تركيز مشابه من القِمْط للتفاعل مع شوارد ها+ المضافة إليه. إلى جانب أنّ مكوّنات المحلول المنظّم من الحمض والقِمْط يجب أن يستهلك بعضها بعضا من خلال تفاعل التعادل، وهذه المتطلّبات يمكن تحقيقها عن طريق الزوج القرين حمض- قِمْط (الحمض الضعيف وقمطه القرين، أو القمط الضعيف وحمضه القرين). يُعرف عدد كبير من المحاليل المنظِّمة، منها: محلول الخَوْلَل acetate، ومحلول الزُّناخ (الأمونيوم)، ومحلول الهوبص، ومحلول البَوْغَس (البورات)، وغيرها.
مثال عن تأثير إضافة قليل من حمض أو قمط إلى محلول منظِّم: عند إضافة قليل من حمض قوي أو قمط قوي، إلى محلول منظِّم، مثل: حمض الخَوْلال (حمض الخليك) وخَوْلَل القُلان (خلات الصوديوم) فإنّ الأها لذلك المحلول المنظّم يبقى تقريبا ثابتا، ويمكن تفسير ذلك على النحو التالي:
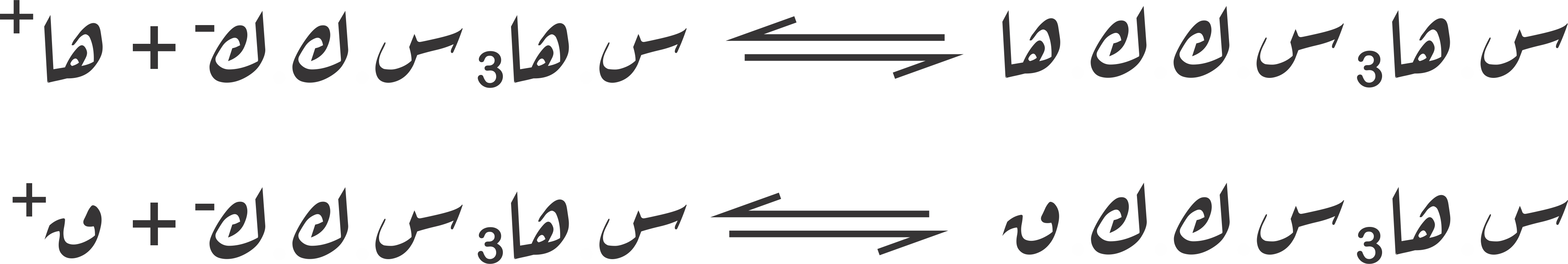
وكما هو واضح، فإنّ حمض الخولال، وهو حمض ضعيف قد تفكّك جزئيا، ونشأت حالة اتّزان بين الشوارد الناتجة والجزء غير المتفكّك من الحمض، بينما نجد أن ملح خولل القلان قد تفكّك كلّية إلى شوارده (تعدّ معظم الأملاح بَراقِم قويّة).