القُوَى البَنْجَزِية هي القوى الموجودة بين الجزيئات والقائمة على تماسكها معا، وهي أساسا قُوى كَهْسَنِية ويتمّ بها تفسير تحوّل المواد بين الأطوار المختلفة الجامدة والسائلة والماهِجة اعتمادا على الحُرورة (درجة الحرارة). ويكون أثر هذه القُوى أكبر في الأطوار المكثّفة للمادةّ (السائلة والجامدة)، فعندما تنخفض الحُرورة تقلّ الطاقة الحركية للجزيئات أيضا، ممّا يؤدّي إلى ضعف حركة الجزيئات، فتقترب من بعضها بعضا أكثر وتتجاذب، فتتكوّن حينئذ قطرات صغيرة سائلة، وهذا الانتقال من الطور الماهِج إلى الطور السائل يُعرف باسم التكاثف. فمثلا 41 إطاق kj كافية لتبخير ماد من الماء على الغَلْوى أي على نقطة الغليان، ولكن لكسر اثنين من الروابط كثار-هُبان فإنّ السال يحتاج إلى 930 إطاق في ماد واحد من الماء. إنّ غَلاوى المواد تعكس مدى قوّة الروابط البنجزية، وعند الغلوى يجب إمداد المادة بالطاقة اللازمة للتغلّب على القوى البنجزية قبل أن تتحوّل المادّة إلى الطور الماهج، فمثلا إذا كانت قيمة القوى البنجزية للمادة «أ» أكبر من قيمة القوى البنجزية للمادّة «ب» فهذا يعني أن غَلْوى المادّة «أ» أعلى من غلوى المادّة «ب»، وهذا ينطبق أيضا على الصُّهُورة، فكلّما كانت هناك صعوبة لإبعاد الجزيئات عن بعضها زادت الصهورة. وهناك أيضا القوى الفَيْجزية التي تربط الذرّات في الجزيء الواحد وتثبّتها فيه، في حين أنّ القوى البنجزية هي التي تحدّد الصفات العامّة والريزيائية للمادة كالصُّهورة والغَلْوى أي درجة الانصهار ودرجة الغليان.
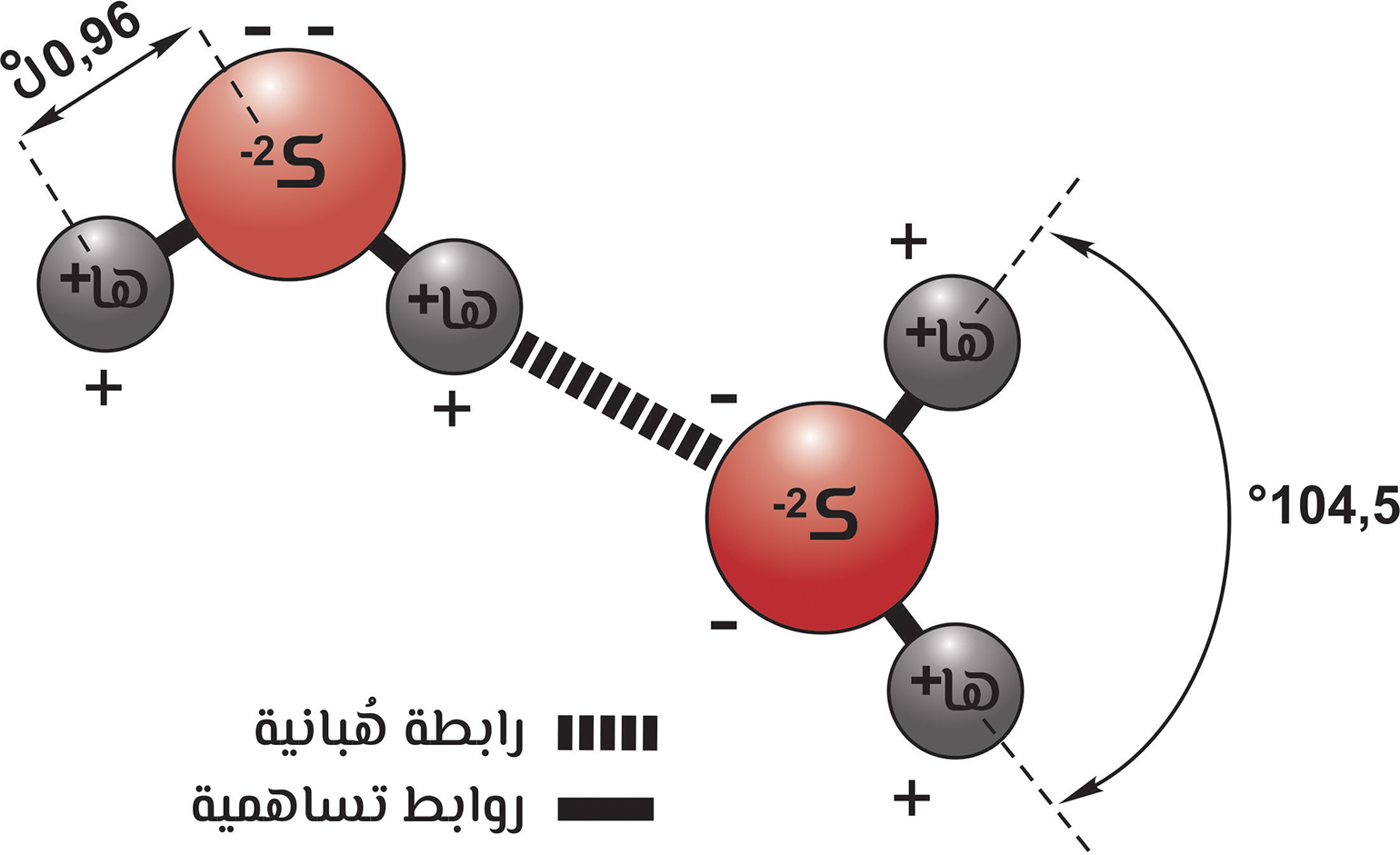
جزيء الماء وروابطه
وبشكل عام فإنّ القوى البنجزية أضعف من القوى الفَيْجَزية، ويحتاج السال إلى طاقة أقل لتبخيره من تكسير الروابط داخل الجزيئات. هناك نوعان رئيسان للقوى البنجزية، النوع الأوّل: القُوى التُّلاوية، وأحيانا يُطلق عليها الكيمياويون قُوى «فانديرفال» تخليدا لذكرى العالم الهولندي «جوهانس فان دير فال»، وتنتج عن التفاعلات الكهربية المعقّدة بين الجزيئات، وهي تجعل الوصف النظري للأمهجة أكثر تعقيدا، ممّا يعني أنّه لا بدّ من وضع شروط تصويبية لنظرية الأمهجة المثالية. أمّا النوع الثاني: فهو الروابط الهُبانية (انظر الشكل) والتي تتكوّن عندما يسعى الهُبان داخل جزيء ما للارتباط بذرّات أو جزيئات مجاورة، وتُعتبر الرابطة الهبانية حالة خاصّة من القُوى القُطبانية-القطْبانية dipole-dipole forces وهي أقوى أنواع القوى البَنْجزية؛ لأنّ بعض العناصر فقط هي التي تشارك فيها. وتنشأ الرابطة الهبانية في الماء السائل والثلج، نتيجة لقُوى التجاذب الكهربي بين ذرّة الهبان في جزيء وذرّة الكُثار في جزيء آخر مجاور، ويكون لذرّة الهُبان القدرة على تمركز نفسها بين ذرتي كُثار ترتبط بإحداها بواسطة رابطة تساهمية قطبية، وبالأخرى بواسطة رابطة هبانية، وتوجد هذه الرابطة في المركّبات التي تحتوي جزيئاتها على ذرّة هبان مرتبطة برابطة تساهمية مع ذرّة أخرى ذات سالبية كهربية عالية، مثل: الدُّجار، أو الكُثار، أو الزُّعات.